发布日期:2022-02-21 来源:GM
1.服务介绍:
透射电子显微镜(Transmission Electron Microscope,简称TEM),可以看到在光学显微镜下无法看清的小于0.2um的细微结构,这些结构称为亚显微结构或超微结构。要想看清这些结构,就必须选择波长更短的光源,以提高显微镜的分辨率。1932年Ruska发明了以电子束为光源的透射电子显微镜,电子束的波长要比可见光和紫外光短得多,并且电子束的波长与发射电子束的电压平方根成反比,也就是说电压越高波长越短。目前TEM的分辨力可达0.2nm。
2.透射电镜结果展示:
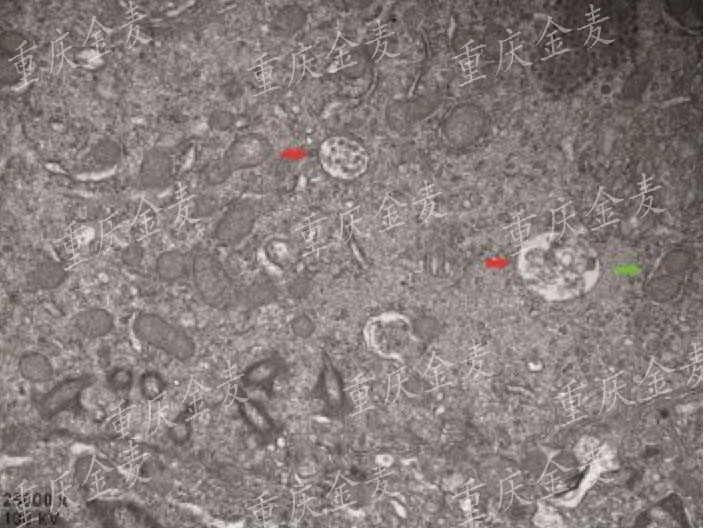
ASCI后肺组织透射电镜观察(红色箭头表示自噬溶酶体,绿色箭头表示自噬小体)
3.透射电镜取材及运输要求:
以下所有样本必须尽量新鲜,固定液或悬浮液都不得冷冻结冰!
1、 动物组织样本
① 1-3min内取样,取样组织2mmX2mm大小,尽量薄。如来不及修整组织大小可先于电镜固定液内固定半小时左右待组织变硬以后再修整组织进行后固定。超出此范围后组织会无法完全固定,后续实验无法完成,务必请重视此过程
② 取材时尽量精确到需要观察的目的部位(如观察肾小球取肾皮质;观察胰岛取胰岛丰富的胰尾;皮肤,肠胃等在固定液中易打卷的组织可将组织粘在滤纸上进行固定)。
③ 取材时一定注意避免镊子挤压等机械损伤,刀片要锋利避免挫伤组织。
④ 组织取下后立即投入电镜固定液内室温固定2h,再转移至4°保存,4°冰袋运输,在保存和运输过程中固定液切勿冷冻结冰。4°时样本可保存1个月左右
2、 植物组织样本
① 取材要求同动物组织样本。
② 组织投入固定液后需要进行真空抽气让组织沉底,如无条件抽气可用滤纸将组织塞进固定液内,组织不能漂浮在固定液表面。
3、 细胞样本
贴壁细胞:
方法一:
①培养好的细胞弃培养基,加入2.5%的常温戊二醛固定液。
②常温固定5min左右,用细胞刮(或软橡胶盖切得平整小方块)沿一个方向轻轻刮下细胞,切记不要反复刮,避免细胞刮破。
③用巴氏吸管把细胞液吸入离心管内,放入离心机(不超过3000转),离心2min左右,细胞团要有绿豆大小。
④弃固定液后加新的电镜固定液,把细胞团轻轻挑起,悬浮于固定液中。
⑥室温避光固定30min,再转移至4°保存,4°冰袋运输,在保存和运输过程中固定液切勿冷冻结冰。
方法二:(对细胞形态没有要求的)
①培养好的细胞弃培养基,加入胰酶。
②胰酶消化好后(时间不宜过长),用培养基终止消化,用吸管把细胞吹下来。吸入离心管,离心(不超过3000转),2min左右,细胞团要有绿豆大小。
③弃上清,加入2.5%的常温戊二醛固定液,把细胞团轻轻挑起,悬浮于固定液中。
④室温避光固定30min,再转移至4°保存,4°冰袋运输,在保存和运输过程中固定液切勿冷冻结冰。
悬浮细胞:离心收集细胞要肉眼可见细胞沉淀绿豆大小,弃培养基后加电镜固定液室温固定2h,再转移至4°保存,4°冰袋运输,在保存和运输过程中固定液切勿冷冻结冰。
4、 细菌样本
长于固体培养基的细菌:连带着培养基一起挑下细菌放于电镜固定液内室温固定2h,再转移至4°保存, 4°冰袋运输,在保存和运输过程中固定液切勿冷冻结冰。
悬浮细菌孢子等:离心收集细菌要肉眼可见细菌沉淀绿豆大小,弃培养基后加电镜固定液室温固定2h,再转移至4°保存,4°冰袋运输,在保存和运输过程中固定液切勿冷冻结冰。
5、 病毒
破碎组织细胞,粗离心去除细胞碎片取上清,超速离心分离出病毒(病毒提取的过程需要客户自己完成)。用缓冲液(如PBS)悬浮病毒,远距离-80°冻存运输,近距离4°保存运输,尽快滴片做负染后及时电镜观察拍照。
6、 外秘体囊泡等
客户自己完成外秘体囊泡等的提取收集,用缓冲液(如PBS)或者试剂盒中的保存液悬浮,远距离-80°冻存运输,近距离4°保存运输,尽快制片做负染后及时电镜观察拍照。(因此类样品极易降解,样品越新鲜越好,*好数小时内完成滴片负染,否则做出的效果很不理想甚至完全观察不到)
7、 纳米材料等无机材料
直接准备粉剂或用缓冲液(如PBS)悬浮,常温保存运输即可(需要超声的备注)。做负染后电镜观察拍照。
Copyright @2021-2022 cqfht.com 重庆金麦生物技术有限公司 渝ICP备2021010685号 技术支持:云威科技 声明:本站部分内容素材来源于互联网,如有侵权请联系管理员删除,谢谢!